Waarom de oceanen CO2 blijven opslaan
De oceaan speelt een cruciale rol in het verzachten van de impact van klimaatverandering. Ongeveer een kwart van alle door menselijke activiteiten uitgestoten CO2 wordt door oceaanwater geabsorbeerd. Maar dit is niet zonder gevolgen voor de verschillende biogeochemische processen en het leven in de oceaan. Een van de belangrijkste eigenschappen die bepaalt hoe efficiënt de oceaan CO2 uit de lucht opneemt is de alkaliniteit van oceaanwater. Alkaliniteit is een maat voor het vermogen van water om weerstand te bieden tegen veranderingen in de pH. De alkaliniteit van oceaanwater vormt een natuurlijke buffer tegen zure toevoegingen aan oceaanwater, zoals het absorberen van atmosferisch CO2.
Een nieuw overzichtsartikel, geschreven door NESSC-onderzoeker Jack Middelburg (Universiteit Utrecht), Karline Soetaert (NIOZ) en Mathilde Hagens (Wageningen University), gaat dieper in op de verschillende aspecten van de alkaliniteit van oceaanwater en de rol die de oceaan heeft in het recyclen van CO2. Het artikel, verschenen in Review of Geophysics, toetst oude inzichten en stelt nieuwe voor.
Verschillende processen
De alkaliniteit van de oceaan wordt, naast het opnemen van CO2 uit de lucht, door een groot aantal andere processen beïnvloed, zowel op korte als lange tijdschalen, schrijven de wetenschappers. Zo vermindert de alkaliniteit door het toevoegen van zuren aan de oceaan, zoals zure regen, terwijl de alkaliniteit toeneemt door het toevoegen van kalk. Ook het afbreken van organisch materiaal (bv. algenresten of dode vissen) in de waterkolom vermindert de alkaliniteit, terwijl afbraakprocessen in een zuurstofloze omgeving de alkaliniteit voornamelijk laten toenemen. Ook de vorming en het oplossen van kalkmineralen in schelpen en koralen zijn van invloed op de alkaliniteit.
Op lange tijdschalen (tienduizenden jaren) zijn er twee processen die bepalend zijn voor de alkaliniteit van oceaanwater: verwering van mineralen op continenten en de vorming van calcium mineralen, onder andere in koralen en schelpen. Omdat er zoveel verschillende bronnen zijn die bijdragen aan de alkaliniteit, is het lastig om een totaalbudget te kunnen schatten, schrijven de auteurs. Ze onderstrepen daarom het belang van meer onderzoek naar mogelijke extra bronnen, zoals de afvoer van anorganische koolstofdeeltjes in rivieren.

Waarschuwing
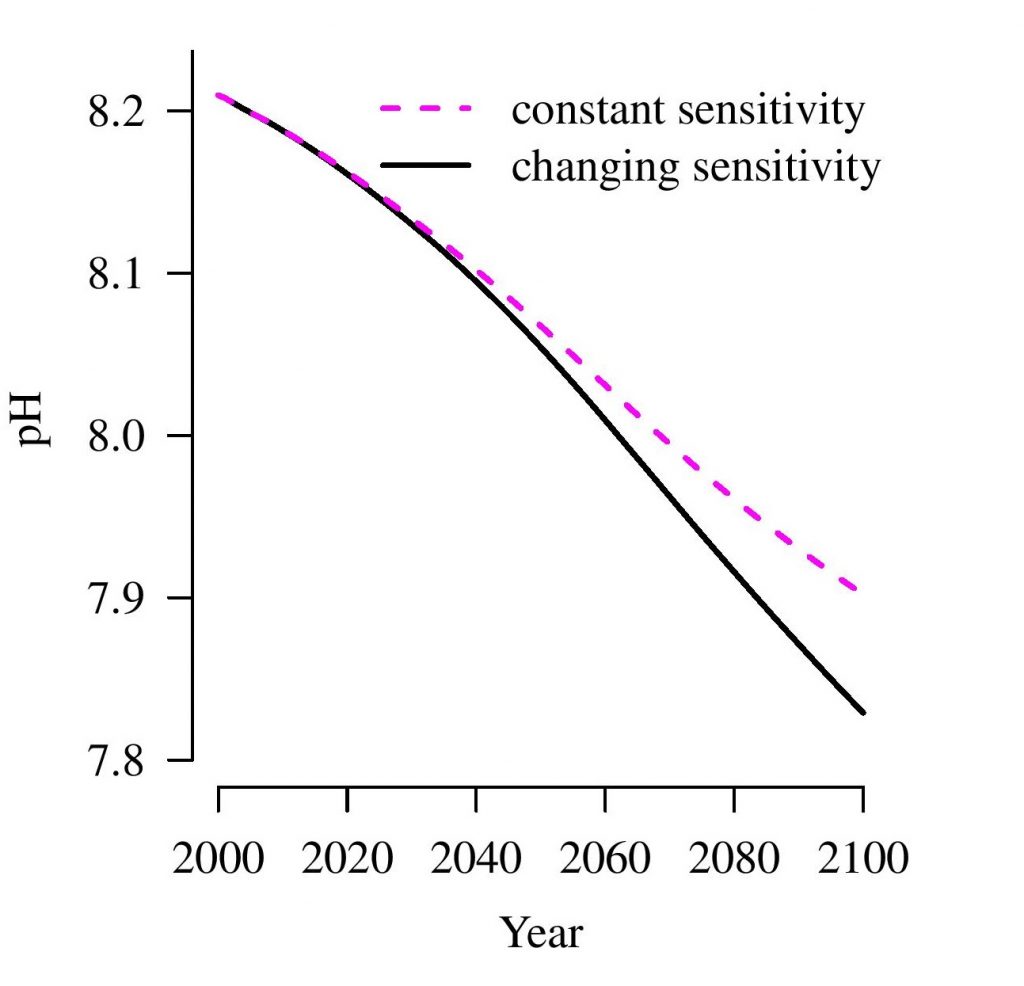
Een steeds verder toenemende hoeveelheid aan CO2 in de lucht kan het absorberend vermogen van de oceaan beïnvloeden. Wanneer oceaanwater CO2 opneemt, verandert de alkaliniteit, waardoor het water langzaam zuurder wordt. Dit heeft weer als gevolg dat de capaciteit van de oceaan om CO2 op te nemen vermindert.
De auteurs waarschuwen dat huidige metingen al een systematische verandering in de alkaliniteit van de oceaan laten zien. Alhoewel deze veranderingen naar verwachting nog eeuwenlang gering zullen blijven, duiden de metingen er wel op dat op steeds grotere dieptes verzuring van oceaanwater plaatsvindt. Men schat dat de pH van oceaanwater aan het einde van deze eeuw al significant kan dalen.
Verwarring
Het artikel stelt ook vast dat er nog de nodige verwarring bestaat over het concept van alkaliniteit, vooral doordat er verschillende definities binnen verschillende onderzoeksvelden worden gehanteerd. Het artikel buigt zich over deze subtiele verschillen, zoals verschillen tussen definities gebruikt door mariene onderzoekers en de definities gehanteerd door scheikundigen en aardwetenschappers. Hoe subtiel ook, deze verschillen worden van belang bij het bestuderen van biogeochemische processen, zoals mineraalvorming. De auteurs verhelderen de veelgebruikte termen om verdere verwarring in toekomstig onderzoek te voorkomen.
Artikel:
Ocean Alkalinity, Buffering and Biogeochemical Processes
Reviews of Geophysics, 2020
Middelburg, J. J., Soetaert, K. and Hagens, M.
https://doi.org/10.1029/2019RG000681

